关于进一步优化第二类医疗器械注册有关事项的通告解读

按现有医疗器械注册质量管理体系核查申报路径,对申请减免注册体系核查,仅进行样品真实性核查情况进行说明◆◆■,并提供:1◆★.在相同地址通过相同医疗器械生产质量管理规范附录体系核查结果通知单复印件(可提供相同附录三类核查结果);2.该产品注册证复印件。
应满足以下条件:1.申报产品为第二类医疗器械;2.在相同生产地址通过了相同医疗器械生产质量管理规范附录核查。
本次申请注册的产品,适用的医疗器械生产质量管理规范附录与原通过核查产品适用的附录一致★◆■。目前国家药监局发布的附录有★★:医疗器械生产质量管理规范附录无菌医疗器械、医疗器械生产质量管理规范附录植入性医疗器械■◆★★■■、医疗器械生产质量管理规范附录体外诊断试剂、医疗器械生产质量管理规范附录定制式义齿、医疗器械生产质量管理规范附录软件■■◆★。
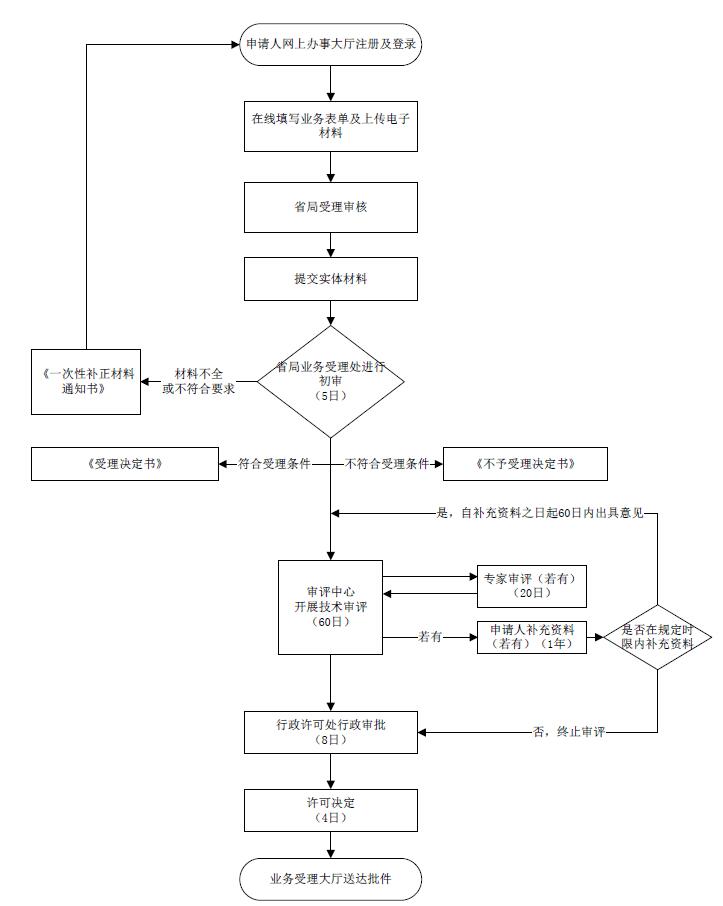
进一步优化广东省第二类医疗器械注册质量管理体系核查程序◆◆★,压缩注册审批时限,提高审批效能。
1.上一年度信用A类企业证明,可提供省局网站A类企业名单截图;2.监督检查材料系指近两年内接受过国家、省、市级药品监管部门的监督检查的记录◆★★■,检查类型包括日常监督检查、飞行检查、跟踪检查★★◆◆◆★、注册质量管理体系核查◆★★■,检查材料应有监管部门的检查结论(结论为:通过或整改后通过核查/检查)和检查人员签名或检查部门盖章。
应满足以下条件:1.申报产品为第二类医疗器械;2.属于上一年度信用A类企业■■■;3◆■◆★.近一年内未有严重违法违规行为。
为进一步贯彻落实国家放管服改革工作精神,加强事中事后监管,结合国家局◆★■◆、省局有关医疗器械生产企业质量信用分类监管精神,省局对社会关注度高的医疗器械注册事项积极探索改革◆■★■,对信用良好的医疗器械生产企业◆★■★,用监督检查材料代替注册核查报告,避免重复检查◆◆■◆◆,激励企业不断完善质量管理体系◆◆,落实企业主体责任★★◆◆。
1.公告发布之日起◆★◆■■,新受理二类产品注册申请的■■,无须申请体系核查。申请人应注册申请表“其它需要说明的问题”栏中说明,并在注册申请材料的“生产制造信息”中提供信用等级凭证及监督检查资料;2★■.公告发布之日前■★◆■◆◆,已受理二类产品注册申请★◆★■◆★,并提交了体系核查申请,但未开展现场核查的,可撤回体系核查申请,在技术审评补充资料时,提供信用等级凭证及监督检查资料。
(四)省局将按照信用管理有关制度,及时更新质量信用等级A类企业名单,对信用等级A类企业名单中撤销的企业◆◆■★,审评审批部门及时停止激励措施。
《广东省药品监督管理局关于进一步优化第二类医疗器械注册有关事项的通告》(2021年第14号,以下简称《通告》)已于2021年2月24日发布,自发布之日起施行。现就《通告》的制定背景、主要内容和需要说明的重点问题说明如下◆■★★:
按照《广东省医疗器械生产企业质量信用分类监管工作的意见(2011年修订)》(粤食药监械〔2011〕110号),根据质量信用划分标准◆◆◆◆◆,省局每年对我省医疗器械生产企业进行质量信用评定,并于每年3月底前在公众网上公布上一年度省级质量信用A类企业名单。
医疗器械注册质量管理体系核查结果通知单中★■■■★,本次核查结论为符合《通告》中关于减免医疗器械注册质量管理体系核查的情形◆★■★◆★,样品真实性核查结论应明确是否通过★■。
(二)样品真实性核查标准为《医疗器械注册质量管理体系核查指南》(国家药监局2020年第19号通告附件)◆■◆。
行政审批时限调整为1个工作日■◆★,不包括技术审评时限,技术审评时限按原规定执行。
(五)审评审批部门认为必要时可开展现场核查,如申报资料真实性存疑、信用等级较低或存在其他需要进一步核实的情况◆★★★■◆。

 400-123-4567
400-123-4567